Experimentos muy interesantes
¿Que pasara?
¿Como hacer una bomba de humo cacera?
.png) La acidez estomacal se presenta como una sensación de ardor en medio del pecho, que ocurre cuando el contenido semidigerido de estómago se regresa a la garganta por el esófago, el tubo que lleva la comida hasta el estómago.
La acidez estomacal se presenta como una sensación de ardor en medio del pecho, que ocurre cuando el contenido semidigerido de estómago se regresa a la garganta por el esófago, el tubo que lleva la comida hasta el estómago. En los casos más graves, se requiere cirugía para curar esta enfermedad pero es posible tratarla con medicamentos e incluso, con una serie de medidamedidas:
En los casos más graves, se requiere cirugía para curar esta enfermedad pero es posible tratarla con medicamentos e incluso, con una serie de medidamedidas: 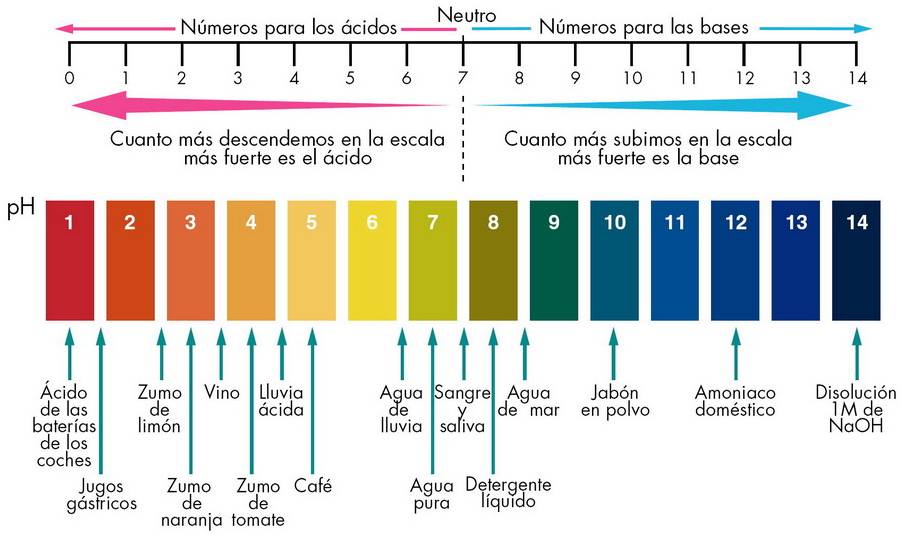 Tanto los ácidos como las bases se encuentran de forma natural en algunas frutas, verduras y otros alimentos nutritivos que incluimos en nuestra dieta. También los utilizamos en la producción de algunos medicamentos; y en artículos para mantener la limpieza de nuestro hogar.
Tanto los ácidos como las bases se encuentran de forma natural en algunas frutas, verduras y otros alimentos nutritivos que incluimos en nuestra dieta. También los utilizamos en la producción de algunos medicamentos; y en artículos para mantener la limpieza de nuestro hogar. El introdujo el concepto de la electronegatividad: es una medida de la capacidad que tiene el núcleo del átomo de un elemento para atraer los electrones de un enlace. El valor más bajo de electronegatividad es (0.7).
El introdujo el concepto de la electronegatividad: es una medida de la capacidad que tiene el núcleo del átomo de un elemento para atraer los electrones de un enlace. El valor más bajo de electronegatividad es (0.7).